یکی از مراحل مهم در مهندسی ژنتیک دایجسشن یا هضم آنزیمی، با استفاده از آنزیم های محدودکننده است. در ادامه میتوانید روش انتخاب آنزیم و انجام آزمایش را مطالعه کنید.
برای آموزش عملی تمامی مراحل مهندسی ژنتیک و کلونینگ با ما تماس بگیرید
۰۹۱۰۱۴۳۸۰۵۲
۰۲۱۴۰۴۴۲۶۷۶
آنزیم های محدودکننده توالی خاصی از DNA دو رشته ای را برش میزنند. تکنیک زیر می تواند مورد استفاده قرار گیرد تا هر قطعه DNA به راحتی منتقل شود، این تکنیک درحالتی کاربرد دارد که محل برش آنزیم ها در دو طرف ژن مورد نظر بوده و مکمل آنها را بتوان در محل مناسبی از وکتور ایجاد کرد تا بتوان ژن را به درون پلازمید منتقل کرد.
آنزیم های محدودکننده (اندونوکلئازهای محدودکننده) پروتئین هایی هستند که DNA را در (یا نزدیک به) مکان های شناسایی خاص برش میزنند (به کاتالوگ تولیدکنندگان یا پایگاه داده آنزیم های محدود کننده مراجعه کنید). دو نوع آنزیم محدود کننده وجود دارد که در نحوه قطع DNA هدف متفاوت عمل میکنند:
- برش با ایجاد انتهای بلانت: این آنزیم های محدودکننده هر دو رشته DNA هدف را در یک نقطه بریده و انتهای صاف ایجاد می کنند.
- برش با ایجاد انتهای چسبنده: این آنزیم های محدودکننده هر دو رشته DNA هدف را در نقاط مختلف برش می دهند و 3′- یا 5′- آزاد و 1 تا 4 نوکلئوتید (به اصطلاح انتهای چسبنده) ایجاد می کنند.
برای اینکه بتوان یک DNA اختصاصی را در یک وکتور کلون یا بیان کرد (کلونینگ DNA)، هر دو باید با دو آنزیم محدود کننده که انتهای مکمل ایجاد می کنند، دایجست شوند. حداقل یکی از آنزیم های محدودکننده مورد استفاده باید یک برش با انتهای چسبنده ایجاد کند تا اطمینان حاصل شود که این ژن اختصاصی در جهت مناسب قرار میگیرد.
ساب کلونینگ با هضم آنزیم های محدودکننده یک روش آزمایشگاهی است که معمولاً استفاده می شود. برای اهداف این آموزش، ما در مورد نحوه انتقال cDNA از یک پلاسمید به پلاسمید دیگر بحث خواهیم کرد. با این حال، از همین روش می توان برای جابجایی پروموترها، مارکرها یا هر توالی DNA دیگری بین پلاسمیدها استفاده کرد.
بیایید فرض کنیم که شما در حال شروع یک پروژه جدید در مورد ژن مورد علاقه خود هستید (به اختصار YGOI). ممکن است لازم باشد YGOI را در سلول های پستانداران کلون کنید. مسئله این است که تنها نسخه cDNA (سنتز شده از روی توالی mRNA) کامل که می توانید برای YGOI پیدا کنید، در یک وکتور بیانی باکتریایی است. با استفاده از ساب کلونینگ، به راحتی می توانید YGOI را به یک وکتور بیانی پستانداران منتقل کنید.
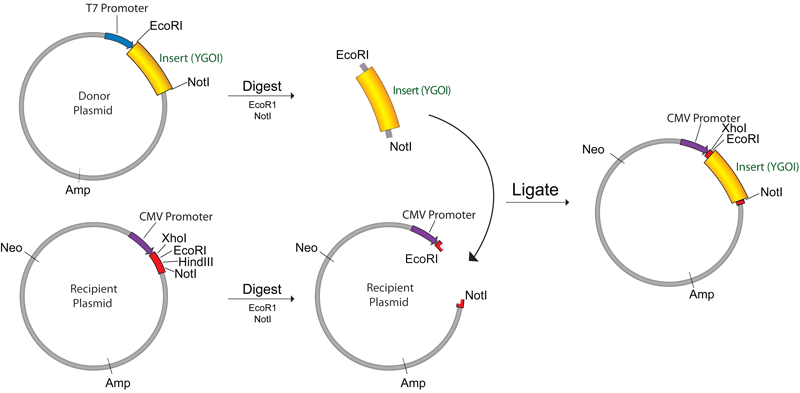
دو طرف ژن دلخواه با دو آنزیم برش داده شده و پلازمید بصورت جداگانه با همان آنزیم های محدودکننده دایجست شده. به این صورت انتهای چسبنده ایجاد شده در پلازمید و ژن مورد نظر مکمل بوده و بهم متصل میشوند.
طراحی (انتخاب آنزیم های محدودکننده)
بسیاری از ابزارهای آنالیز DNA، از جمله سایت Addgene، به شما امکان این را می دهد محل های برش آنزیم های محدودکننده را در یک توالی مشخص کنید. هنگام انتخاب آنزیم های محدود کننده، آنزیم هایی را انتخاب کنید که:
- دو طرف ژن مورد نظر شما را برش دهد و جایگاه برشی در وسط آن نداشته باشد.
- جایگاه برش آن آنزیم در محل مورد نظر در پلاسمید نیز قرار داشته باشد . ترجیحا در محل کلونینگ چندگانه (MCS) . اما در جای دیگر پلاسمید را برش ندهد.
- منجر به قرارگیری ژن شما در پلاسمید گیرنده شود. (مراقب باشید که شما نمی خواهید نسخه آنتی سنس ژن خود را بیان کنید!)
- جایگاه برش در یک محل مناسب نسبت به ژن های موردنظر برای انتخاب کلونی حامل پلازمید و کلونی حامل پلازمید نوترکیب باشد. (مقاله انتخاب کلنی را در آینده منتشر خواهیم کرد.)
در حالت ایده آل، شما دو آنزیم محدودکننده مختلف برای subcloning خود پیدا خواهید کرد. همچنین می توان از یک آنزیم منفرد استفاده کرد، اما در این صورت مجبور میشوید پلاسمید گیرنده را با فسفاتاز تیمار کنید و همچنین به یک تست هضم آنزیمی خاص برای تأیید صحت کلون شدن آن نیاز دارد.
اگر نمی توانید آنزیم های محدودکننده ای پیدا کنید که با این معیارها مطابقت داشته باشند، نترسید. شما گزینه های دیگری دارید، مانند:
- افزودن توالی آنزیم محدودکننده دلخواه به دو طرف ژن موردنظر:
می توانید از کلونینگ مبتنی بر PCR استفاده کرده و توالی برش آنزیم محدودکننده را به انتهای الیگوهای خود اضافه کنید. به شما امکان این را می دهد که نسخه ای از ژن دلخواه خود را در کنار محل های برش آنزیم محدود کننده سازگار با MCS پلاسمید گیرنده تولید کنید. با این حال، شما هنوز هم باید از آنزیم های محدود کننده که در داخل توالی ژن موردنظر شما قرار دارند اجتناب کنید.
- افزودن توالی آنزیم محدود کننده مورد نظر به پلاسمید گیرنده:
با استفاده از Annealed-oligo Cloning می توانید MCS پلاسمید گیرنده خود را اصلاح کنید.
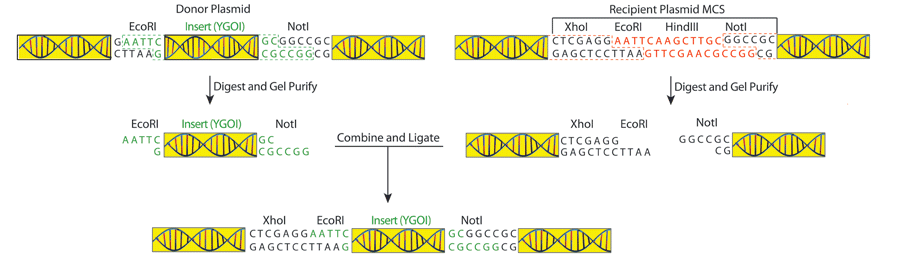
ژن موردنظر با دو آنزیم مختلف از پلازمید دهنده جدا شده . پلازمید با همان دو آنزیم دایجست شده . این باعث ایجاد توالی های مکمل شده تا ژن مورد نظر در جهت درست درون پلازمید گیرنده قرار بگیرد.
اگر شما به اندازه کافی خوش شانس هستید که گزینه های مختلفی برای آنزیم های محدودکننده ای که مناسب ژن موردنظر شما هستند، وجود دارد و منجر به جهت گیری صحیح در پلاسمید گیرنده می شود، خوب است که ببینید آیا یک مجموعه از آنزیم ها در همان بافر آنزیم محدود کننده کار می کنند (برای اطلاعات بیشتر در مورد بافرهای آنزیم های محدودکننده به New England Biolabs مراجعه کنید ). اگر آنزیم هایی را انتخاب کنید که می توانند در یک بافر کار کنند، در مراحل بعدی در وقت شما صرفه جویی می شود.
آنزیم های محدودکننده را برای پلاسمیدهای دهنده و گیرنده خود انتخاب کنید. از آنجا که در مرحله تخلیص ژل (پس از جداسازی پلازمید) مقداری DNA از دست می دهید، مهم است که مقدار زیادی از پلازمیدها دایجست شود. ما μg 1.5-2 پلاسمید دهنده و 1μg پلاسمید گیرنده را توصیه می کنیم. همچنین بسیار مهم است که تا آنجا که ممکن است پلاسمید گیرنده با هر دو آنزیم بریده شود.
اگر قرار است فقط از یک آنزیم محدود کننده یا آنزیم های محدودکننده ای استفاده کنید که پس از دایجست دارای انتهای چسبنده مکمل خواهد بود و یا هیچگونه انتهای آزادی ندارند، برای جلوگیری از اتصال مجدد پلاسمید گیرنده، باید از فسفاتاز استفاده کنید. بسته به فسفاتازی که انتخاب می کنید، باید قبل از مرحله لایگیت (اتصال) یا قبل از مرحله تصفیه ژل، پلاسمید گیرنده دایجست شده خود را با فسفاتاز تیمار کنید. معمولاً از CIP (آلکالن فسفاتاز گوساله) یا SAP (آلکالن فسفاتاز میگو) استفاده می شود.
پروتکل دایجست با یک آنزیم محدود کننده
- مواد را به ترتیب به میکروتیوب اضافه کنید:
1 میکرولیتر DNA (غلظت 1 میکروگرم / میکرولیتر)
2 میکرولیتر بافر 10X آنزیم
1 میکرولیتر آنزیم محدود کننده
16 میکرولیتر آب مقطر استریل
- واکنش را در دمای عملکرد آنزیم (معمولاً 37 درجه سانتیگراد) به مدت 1 ساعت انکوبه کنید.
- هضم را با غیرفعال کردن با استفاده از گرما (65 درجه سانتیگراد به مدت 15 دقیقه) . همین طور می توانید با افزودن 10 میلی مولار EDTA متوقف کنید.
- مقداری از DNA دایجست شده را برای اطمینان از صحت دایجست می توانید روی ژل آگارز ران کنید . در صورت نیاز آن را از ژل تخلیص کنید.
- DNA هضم شده برای استفاده در کاربردهای تحقیقاتی آماده است.
هنگام استفاده همزمان از دو آنزیم محدود کننده، ابتدا با استفاده از جدول موجود در مرجع بافر آنزیم محدود کننده، فعالیت آنزیم را در هر بافر بررسی کنید. اگر هر دو فعالیت 100٪ در یک بافر دارند، می توانید با استفاده از آن بافر پروتکل دایجست خود را ادامه دهید. در روش دیگر، بافر مطلوب را می توان از نمودار دایجست دوگانه تعیین کرد. در بعضی موارد هم، انجام چند دایجست پشت سرهم، به دلیل عدم سازگاری بافر (ترکیب یا دما) توصیه می شود.
برای آموزش عملی تمامی مراحل مهندسی ژنتیک و کلونینگ با ما تماس بگیرید
۰۹۱۰۱۴۳۸۰۵۲
۰۲۱۴۰۴۴۲۶۷۶
پروتکل دایجست با دو آنزیم محدودکننده
- مواد را به ترتیب به میکروتیوب اضافه کنید:
1 میکرولیتر DNA (غلظت 1 میکروگرم / میکرولیتر)
2 میکرولیتر بافر 10X آنزیم
1 میکرولیتر از هر آنزیم محدود کننده
15 میکرولیتر آب مقطر استریل
- واکنش را در دمای هضم (معمولاً 37 درجه سانتیگراد) به مدت 1 ساعت انکوبه کنید.
- فعالیت آنزیم را با استفاده از گرما غیرفعال کنید (65 درجه سانتیگراد به مدت 15 دقیقه) . همین طور می توانید با افزودن 10 میلی مولار EDTA واکنش را متوقف کنید.
- مقداری از DNA دایجست شده را برای اطمینان از صحت دایجست میتوانید روی ژل آگارز ران کنید . در صورت نیاز آن را از ژل تخلیص کنید.
- DNAدایجست شده برای استفاده در کاربردهای تحقیقاتی آماده است.
پروتکل انجام چند دایجست پشت سرهم با آنزیم های محدودکننده
- مواد را به ترتیب به میکروتیوب اضافه کنید:
1 میکرولیتر DNA (غلظت 1 میکروگرم / میکرولیتر)
2 میکرولیتر بافر 10X آنزیم
1 میکرولیتر آنزیم محدود کننده
1۶ میکرولیتر آب مقطر استریل
- واکنش را در دمای هضم (معمولاً 37 درجه سانتیگراد) به مدت 1 ساعت انکوب کنید.
- فعالیت آنزیم را با استفاده از گرما غیرفعال کنید (65 درجه سانتیگراد به مدت 15 دقیقه) . همین طور می توانید با افزودن 10 میلی مولار EDTA واکنش را متوقف کنید.
- DNA را با استفاده از یک کیت تخلیص کنید . DNA را مجدداً حل کرده و 1 میکروگرم در لیتر رقیق کنید.
- هضم دوم را طبق مرحله 1 آماده کنید و تا مرحله 3 را ادامه دهید.
- مقداری از DNA دایجست شده را برای اطمینان از صحت دایجست میتوانید روی ژل آگارز ران کنید و در صورت نیاز آن را از ژل تخلیص کنید.
- DNA هضم شده برای استفاده در کاربردهای تحقیقاتی آماده است.
ژن موردنظر (الحاقی) و وکتور را با استفاده از ژل آگارز تخلیص کنید
DNA هضم شده خود را بر روی ژل آگارز ران کرده و برای جداسازی DNA، یک تخلیص ژل انجام دهید. هنگام استفاده از یک ژل برای تخلیص، داشتن باندهای تمیز و خوب و داشتن فضای لازم برای برش باندها مهم است. به همین دلیل توصیه می کنیم از یک شانه ژل پهن استفاده کنید و ژل را با ولتاژ کمتری ران کنید. علاوه بر مارکر DNA، بهتر است یک نمونه برش نخورده از هر پلاسمید را نیز برای کمک بررسی صحت دایجست استفاده کنید. در این صورت اگر دایجست های شما مطابق انتظار شما نبود بدانید درست انجام شده یا خیر.


2 نظر در “هضم ژن با آنزیم های محدودکننده در مهندسی ژنتیک”
خیلی عالی و مفهومی توضیح داده شده ، بی نهایت مفید بود ، ممنونم
خوشحالیم برای شما مفید بوده.