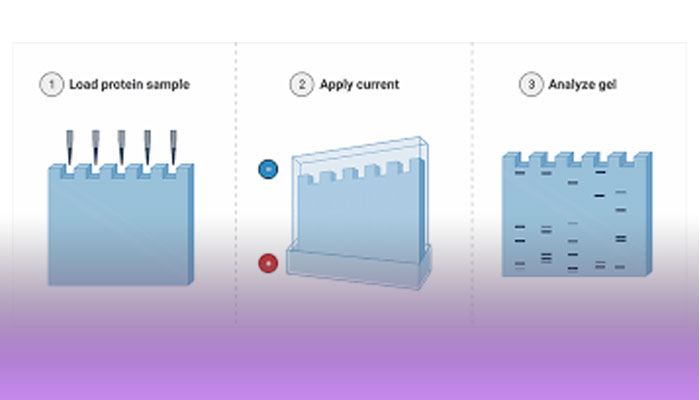
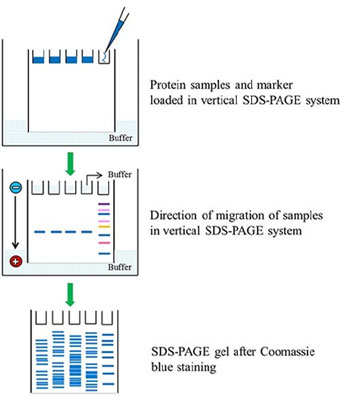
تکنیک SDS-PAGE برای بررسی پروتئین ها استفاده میشود که در بسیاری از زمینه های بیولوژی استفاده میشود. در این مقاله قصد داریم درباره این تکنیک توضیحات کامل را ارائه دهیم. همچنین آزمایشگاه همکار و شرکت دانش بنیان پویاژن آزما دارای دوره هایی میباشد که شما میتوانید این تکنیک را بصورت کامل آموزش دیده و خودتان انجام دهید. این تکنیک را میتوانید در دوره های تخلیص پروتئین و مهندسی ژنتیک پیشرفته نیز انجام دهید.
سرفصل های دوره SDS-PAGE:
کشت باکتری های نوترکیب و القا بیان
آماده سازی پروتئین داخل سلولی
SDS-PAGE
این دوره دو روزه و با قیمت 900 هزار تومان میباشد.
همچنین میتوانید در کنار این دوره تخلیص پروتئین را نیز انجام دهید که با افزودن این مورد دوره سه روزه بوده و هزینه آن 1 میلیون و 700 خواهد بود.
برای ثبت نام میتوانید از طریق شماره تماس و یا فرم این لینک برای ما درخواست ارسال بفرمایید.
این تکنیک برای کسانی که در زمینه پروتئومیکس فعالیت دارند بسیار مورد استفاده قرار میگیرد. همچنین برای بررسی ابتدایی بیان پروتئین های نوترکیب نیز مورداستفاده قرار میگیرد.
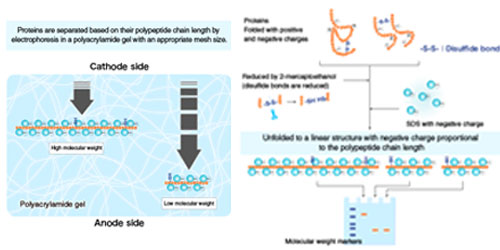
SDS-PAGE (sodium dodecyl sulfate–polyacrylamide gel electrophoresis) یک سیستم الکتروفورزی نامداوم هست که توسط Ulrich K. Laemmli اختراع شد که به عنوان روش رایج برای جداسازی پروتئین هایی با وزن مولکولی بین 5 تا 250 کیلو دالتون استفاده می شود. استفاده ترکیبی از این دو ماده SDS و polyacrylamide gel این اجازه را به ما می دهد تا تاثیرات ساختار و بار را خنثی کرد و پروتئین ها فقط براساس وزن مولکولی خود جدا شوند.
در وسط ژل نامداوم باز پلی آکریلامید قرار دارد که به عنوان ماتریکس نیز شناخته می شود. این ژل معمولا به حالت ساندویچ در بین دو پلیت شیشه ای قرار میگیرد. با اینکه ژل های لوله ای (سیلندر های شیشه ای) به صورت افقی استفاده می شدند به سرعت با اختراع slab ژل های مناسب بیشتر پر بازده تر شدند و هم چنین از SDS نیز استفاده شد.
حدود 1.4 گرم از SDS با یک گرم از پروتئین پیوند تشکیل می دهد در واقع هر مولکول SDS با دو امینو اسید پیوند ایجاد می کند.
SDS به عنوان یک سورفاکتانت عمل می کند به طوری که بار طبیعی پروتئین را می پوشاند و بار آن ها را بسیار مشابه بار نسبت های جرمی میکند. بار طبیعی پروتئین در مقابل SDS بسیار ناچیز است و هم چنین بار های مثبت در بازه ی اصلی pH ژل جدا کننده به طور چشم گیری کاهش می یابد.
در طی انجام آزمایش که سطح به طور مداوم دارای الکتریسیته است هر پروتئین با سرعت متفاوتی متناسب با وزن خود به سمت انود می رود. این پروسه ی ساده اجازه ی جداسازی دقیق پروتئین ها را به ما می دهد.
SDS در محلول های آبی بالا تر از یک حد مشخص غلظت تمایل دارد به شکل میسل های کروی دربیاید به این غلظت critical micellar concentration (CMC) گفته می شود 7 تا 10 میلی مولار بالاتر از CMC در محلول ها همگی مولکول های SDS به صورت تک مولکولی (مونومر) و به عنوان میسل در می آید.
در حالی که فقط مونومر های SDS به پروتئین توسط واکنش هیدروفوبیک متصل می شوند این درحالی است که سطح بیرونی میسل های SDS آنیونیک هستند و پروتئین دیگری را جذب نمی کند. به دلیل اینکه در حالت طبیعی SDS آمفیپاتیک هستند می توانند به هر دو قسمت قطبی و غیر قطبی ساختار پروتئین را unfold کند.
در SDS غلظت بالای 0.1 میلی مولار باز شدن پروتئین ها رخ می دهد و بالای 1 میلی مولار بیشتر پروتئین ها دناتوره شده اند. به علت تاثیر شدید SDS وگسستگی متعاقب ساختارهای چهارم به طور معمول قابل شناسایی با SDS نیستند.
استثنا پروتئین هایی هستند که با پیوند کراس کووالانت مانند پیوند های -S-S- و کمپلکس پروتئین مقاوم SDS (که حتی در حضور SDS نیز ثابت هستند) (البته فقط در دمای اتاق) ثابت شده اند. برای دناتوره کردن کمپلکس های مقاوم SDS، انرژی فعال سازی بالایی لازم است که با گرم کردن به دست می آید.
ژل پلی آکریلامید از واکنش آکریلامید و بیس آکریلامید(N,N’-methylenebisacrylamide) با کراس لینک قوی در ژل ماتریکس شکل می گیرند.
برای خرید کیت استخراج DNA و پلاسمید از انواع نمونه ها و محصولات مولکولی کلیک کنید.
تاریخچه
در سال 1948 آرن تیسلیوس برای کشف قوانین الکتروفورز در حرکت اتم ها و مولکول های بار دار در الکتروفورز جایزه ی نوبل دریافت کرد. سپس از ماتریکس جامد (ابتدا دیسک کاغذی) در محیط الکتروفورزی استفاده شد که جداسازی را بهبود داد. الکتروفورز نا مداوم در سال 1964 جداسازی با اثر انبوه سازی، جداسازی را بهبود داد.
استفاده از هیدروژل پلی آکریلامید کراس لینک برخلاف استفاده های قبلی از دیسک های کاغذی یا ژل های نشاسته ای، ثبات بالای ژل، بدون تجزیه ی میکروبی را فراهم می کند. نوع کنونی SDS-PAGE در 1970 توسط Ulrich K. Laemmli شرح داده شد. در ابتدا این روش برای مشخص کردن پروتئین های سر باکتروفاژ T4 استفاده شد.
polyacrylamide gel electrophoresis می باشد. پروسه ابتدا از دناتوره کردن پروتئین ها با یک شوینده ی آنیونی شروع می شود که به آنها متصل می شود و بار منفی به آنان میدهد. در مرحله ی بعدی جداسازی پروتئین ها توسط ماتریکس ژل آکریلامید حفره دار با کیفیت بالا انجام می شود.
بخش اعظم این روش از دهه ی 70 میلادی که معرفی شد بدون تغییر باقی ماند. این روش در مواردی که نیاز به حفظ ساختار یا عملکرد طبیعی پروتئین ندارند به خوبی عمل می کند. پس از این روش در خالص سازی پروتئین ها ، ارزیابی بیان پروتئین ها، شناسایی ایمونوکمیکال و تعداد پروتئین ها (وسترن بلات) می توان استفاده نمود.
و به علت محدودیت در حفظ ساختار پروتئین ها از این روش نمی توان در فعالیت های آنزیمی، واکنش های پروتئین باندینگ، تعیین کوفاکتور های پروتئین و غیره استفاده کرد. پس در این موارد باید از روش های دیگری مانند blue-native PAGE بهره برد.
اصول کار SDS-PAGE
مولکول های باردار زمانی که در محیط الکتریک قرار می گیرند به سمت الکترود با بار مخالف حرکت میکنند. جداسازی مولکول های باردار به تحرک گونه های باردار بستگی دارد. هرچه مولکول ها کوچکتر باشند به علت کاهش مقاومت در حین الکتروفورز سریع تر حرکت می کنند.
هم چنین ساختار و بار پروتئین ها در سرعت حرکت تاثیر می گذارند. سدیم دودسیل سولفات و پلی آکریلامید اثر ساختار و بار را حذف می کنند در نتیجه پروتئین ها براساس طول زنجیره پلی پپتیدی جدا می شوند.
نقش SDS در SDS-PAGE
SDS شوینده ای در بافر SDS-PAGE است که به کمک عوامل کاهنده پیوند های دی سولفیدی را می شکند و ساختار سوم پروتئین را مختل می کند.
مواد لازم:
منبع انرژی: برای تبدیل AC به DC
ژل: میتوان درآزمایشگاه تهیه کرد و یا به صورت کست های آماده خریداری کرد.
نمونه پروتئین: پروتئین با بافر SDS-PAGE رقیق شده و به مدت 10 دقیقه بجوشد.
عوامل کاهنده مثل dithiothreitol یا 2-mercaptoethanol برای کاهش پیوند های دی سولفید برای جلوگیری از تشکیل ساختار سوم
بافر ران کننده: نمونه پروتئین ها لود شده در ژل که در بافر قرار گرفته ران می شود.
رنگ آمیزی با محلول دیستینینگ: ژل با محلول رنگ کوماسی رنگ امیزی می شود. سپس رنگ ژل با محلول رنگ بری برداشته می شود. سپس باند های پروتئین با چشم غیر مصلح قابل دیدن خواهند بود.
نردبان پروتئین: یک لدر پروتئین به عنوان مرجع برای تعیین موقعیت پروتئین مورد نظرگذاشته می شود.
پروتکل SDS-PAGE
آماده سازی ژل
تمام معرف ها به جز TEMED برای اماده سازی ژل مخلوط می شوند. هنگامی که ژل آماده ی ریختن هست TEMED اضافه می شود. نهایتا ژل در کاست ریخته می شود.
قبل از پلیمریزاسون بوتانول برای حذف حباب ها اضافه می شود. شانه درفضای بین پلیت شیشه گذاشته می شود.
ژل پلیمریزه کننده به عنوان ژل کاست شناخته می شود.
آماده سازی نمونه
مقداری اب را به جوش بیارید.
به بافر 2-mercaptoethanol را اضافه نمایید.
محلول بافر را در تیوب میکروفیوژ قرار دهید و نمونه ی پروتئین را به ان اضافه نمایید.
در تیوب های جداگانه مارکر های MW بریزید.
نمونه ها را کمتر از 5 دقیقه بجوشانید تا پروتئین ها کاملا دناتوره شوند.
الکتروفورز
ژل کاست از کاست برداشته شود و در کنارمحل قرار گیری الکترود گذاشته می شود.
بافر الکتروفورز 1X در قالب کاست ریخته می شود تا ژل و چاهک ها را بپوشاند.
سپس در تانک گذاشته می شود و به منبع انرژی وصل می شود.
نمونه اجازه دارد در 30mA برای یک ساعت ران شود.
سپس باند ها زیر نور UV قابل مشاهده هستند.
کاربرد های SDS-PAGE
اندازه گیری وزن مولکولی مولکول ها
تخمین انداره ی پروتئین
پپتید مپینگ
مقایسه ی ترکیب بندی پلی پپتید های ساختار های مختلف
تخمین خلوص پروتئین
وسترن بلات و یوبیکویتیناسیون پروتئین
تست HIV برای جداسازی پروتئین های HIV
انالیز اندازه و تعداد زیرواحد های پلی پپتید
انالیز تغییرات بعد از ترجمه
اصول SDS-PAGE
مراحل انجام کار
آماده سازی پلی آکریلامید ژل
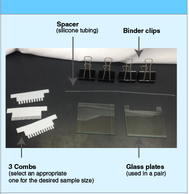
لوازم مورد نیاز: شانه، پلیت های شیشه ای، اسپیسر (سیلیکون تیوب)، گیره کاغذ
شانه برای ایجاد چاهک جهت لود نمونه استفاده می شود. (بر اساس اندازه نمونه خود از شانه مناسب استفاده کنید. برای مثال برای نمونه ای با تعداد 7 عدد و یک مارکر وزن مولکولی از شانه 8 دندانه استفاده کنید.
لوازم مهم برای SDS-PAGE
با دقت پلیت های شیشه ای را با اتانول تمییز کنید و کاست ژل را سرهم کنید.

برای ژل جداکننده، محلول پلی آکریلامید را بریزید. برای جلوگیری از تماس آن با هوا (اکسیژن) تا روی آن اب بریزید چرا که اکسیژن پلیمریزاسیون را محدود می کند.
به ژل 20 تا 30 دقیقه زمان بدهید تا ببندد. سپس آب را دور بریزید.
پلیمریزاسیون ژل پلی آکریلامید
پروتئین ها بسته به غلظت ژل جداکننده با سرعت های متفاوتی حرکت می کنند.
پس برای پرتیین هدف خود از غلظت مناسب ژل استفاده کنید.
هرچه غلظت آکریلامید بیشتر باشد ژلی با منفذ های کوچک تر خواهیم داشت که برای جداسازی پروتئین های کوچک مناسب است. به طور معمول غلظت آکریلامید بین 6 تا 15% استفاده می شود.

ریختن محلول آکریلامید برای ژل جداکننده
محلول آکریلامید را برای انبوه سازی ژل بریزید؛ سپس شانه را قرار دهید و اجازه دهید آکریلامید پلیمریزه شود.
پروتئین ها در ابتدا هنگام عبور از ژل انبوه سازی به ژل جداکننده بسیار غلیظ هستند. این غلظت به علت تفاوت در سرعت حرکت یون گلایسین، یون کلراید و پروتئین ها می باشد.

اصول انبوه سازی
ریختن محلول آکریلامید برای ژل انبوه ساز
آماده سازی نمونه
به نمونه بافر را اضافه کرده و با تکان دادن تیوب هم میزنیم.
نمونه ها را در دمای 100 درجه سیلیسیوس به مدت 3 دقیقه گرم می کنیم.
سپس نمونه ها را به مدت 1 دقیقه در دمای 4 درجه با 15000 rpm سانتریفیوژ می کنیم. همچنین از سوپرناتانت برای SDS-PAGE استفاده می کنیم.
الکتروفورز
گیره های کاغذ، اسپیسر و شانه را برمی داریم و بااستفاده از گیره کاغذ ژل را در دستگاه الکتروفورز قرار می دهیم.
بافر را در بالا و پایین چاهک ریخته و تمام حباب ها و قطعات کوچک ژل را از چاهک ها و زیر ژل با استفاده از سرنگ از بین می بریم.

پلیت ژل روی دستگاه الکتروفورز گذاشته می شود.
نمونه ها و مارکر وزن مولکولی به درون چاهک ها لود می شوند.
منبع انرژی را روشن کرده و ژل را ران کنید تا زمانی که رنگ (BPB) در بافر نمونه به انتهای ژل برسد.

ژل انبوه ساز را از دستگاه الکتروفورز بردارید. ژل را با استفاده از اسپاچول از پلیت شیشه ای جداکنید و برای آنالیز آماده کنید.

برای آموزش های حضوری و کارآموزی میکروبیولوژی و مولکولی یعنی انجام دادن تمام تکنیک ها توسط خودتان میتوانید با ما تماس بگیرید.
09101438051
021404436-7
برای خرید کیت استخراج DNA از انواع نمونه ها و محصولات مولکولی کلیک کنید.
امیدواریم این مقاله برای شما مفید بوده، همچنین میتوانید درباره نکات کار در آزمایشگاه میکروبیولوژی مطالعه کنید و اگر به این مبحث علاقمند هستید میتوانید از این لینک به زبان انگلیسی درباره آنزیم بتاگالاکتوزیداز مطالعه کنید.
سوالات پر تکرار
علت پلیمرزه نشدن ژل چیست؟
عوامل مختلفی می تواند در این موضوع دخیل باشد، اما چون شروع کننده ی واکنش پلیمریزه شدن در واقع با واکنش بین TEMED و APS رخ می دهد، به احتمال زیاد با تغییر دادن ماده، یا بیشتر کردن غلظت آن ها می توان مشکل را حل کرد.
باندهای ژل به صورت اسمیر دیده می شود، علت آن چیست؟
یکی از مهم ترین دلایل اسمیر شدن باند، خوب نبودن کیفیت بافرهای استفاده شده در ساخت ژل است؛ مقادیر بافرها را با دقت بسازید و دقیق تنظیم pH کنید. علت دیگر مناسب نبودن ولتاژ برق منبع تغذیه است، ولتاژ زیاد بالا یا پایین می تواند عامل ایجاد باند اسمیر مانند شود.
چرا ژل ساخته شده شکننده است؟
احتمال زیاد مقدار اکریل آمید و بیس آکریل آمید مناسب نبوده، مقدار بیس آکریل آمید را افزایش دهید.
پروتئین های آماده شده پس از مخلوط شدن با بافر نمونه حالت کشسانی دارد و داخل ژل به سختی لود می شود. راه حل چیست؟
علت کشسان بودن بافر نمونه معمولا دناتوره نشدن پروتئین هاست. نمونه ها را 5 دقیقه بیشتر جوشانده سپس سانتریفوژ کنید و از محلول رویی برای لود نمونه استفاده کنید.
همچنین این شرکت دانش بنیان تولید کننده انواع سیستم تصفیه آب صنعتی بر پایه بیوفیلتر میباشد.