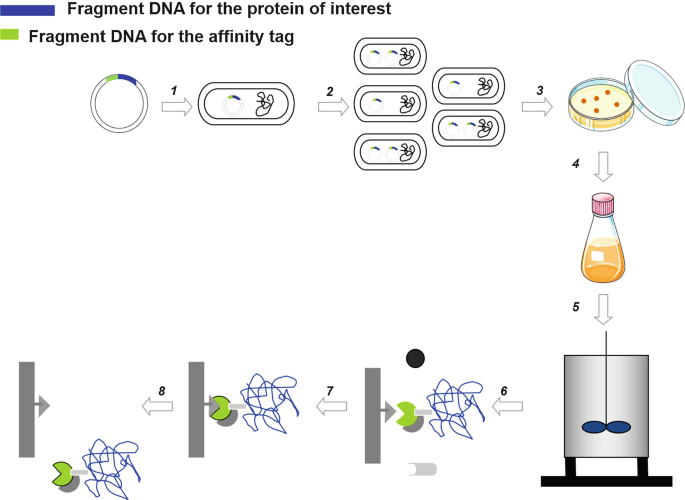
انواع روش های تخلیص پروتئین
تولید پروتئینها با خلوص بالا و حفظ ساختار و ویژگی پروتئین، هدفی مهم در صنایع مختلفی همچون داروسازی است، پروتئینهای مختلف به علت داشتن میزان بیان، حلالیت، پایداری و عملکرد زیستی متفاوت تبدیل به هدفی سخت برای انجام کارهای تحقیقاتی، تولیدی و آنالیزی گردیدهاند. از اینرو دانشمندان روشهای مختلفی را برای از میان برداشتن این موانع انجام میدهند؛ مثل انتخاب سیستم بیانی و میزبان مناسب، بالا بردن پایداری mRNA ، بهینه سازی رمزهای ژنتیکی توالی هدف بر اساس تمایل کدنی میزبان، استفاده از مسیرهای ترشحی برای خارج کردن پروتئین از سلول میزبان، تغییرات پس از ترجمه، بیان همزمان با چپرونهای مختلف و کاهش میزان فعالیت پروتئولیتیک سلول از جمله این تکنیکها میباشد. اما جالب توجه است که اضافه نمودن یک دنبالهی پروتئینی به پروتئین نوترکیب به صورت همزمان باعث افزایش میزان بیان پروتئین، حلالیت، حفظ فعالیت زیستی و تخلیص پروتئین میگردد. دنباله های پپتیدی دارای ویژگیهایی از جمله حداقل تاثیر بر روی ساختار سوم و فعالیت بیولوژیکی پروتئین میباشند. این گروه از دنبالهها در یک قسمت از توالی پپتیدی دارای فعالیت پروتئولیتیک قابل القا هستند. نکته جالب توجه این است که میتوان این دنبالهها را به هرنوع پروتئینی بدون نیاز به داشتن دانش کامل نسبت به آن پروتئین فیوز کرد. دیگر اینکه در مواردی دیده شده حتی این دنبالهها باعث کاهش اثر کشندگی در پروتئینهایی که برای باکتری کشنده و سمی هستند میگردند.
دنباله های پروتئینی در واقع توالیهایی پپتیدی هستند که با روشهای مهندسی ژن به پروتئینهای نوترکیب مورد استفاده در تحقیقات متصل میگردند. این دنبالهها معمولا در انتهای کار با استفاده از مواد شیمیایی، آنزیم هایی نظیر پروتئاز ها و یا پیرایش خود به خودی از پروتئین نوترکیب جداسازی میشوند. این دنبالهها با اهداف مختلفی به پروتئین نوترکیب متصل میگردند.
برخی دنبالههای پپتیدی به اندازهای کوچک هستند که نیازی به جداسازی آن از پروتئین هدف نیست؛ در حالی که برخی دنبالههای دیگر از نظر اندازه بزرگ هستند و به همین خاطر باعث افزایش حلالیت پروتئین تولید شده میگردند. البته در کنار این مزیت، این ایراد را نیز دارند که حتما باید پس از تولید از پروتئین هدف جدا بشوند؛ گاه این مرحله جداسازی نیازمند شرایط و موادی است که از نظر هزینه ای به هیچ وجه به صرفه نبوده و مانع از استفاده از این روشها در مقایس بزرگ و صنعتی میگردد. این جداسازی اصطلاحا کلیواژ نامیده میشود. کلیواژ معمولا با کمک ترکیبات شیمیایی خاص و یا با کمک آنزیمها انجام میگردد و به این ترتیب محل اتصال پروتئین نوترکیب و دنبالهی پپتیدی خواهد شکست. مواد شیمیایی مورد استفاده از کلیواژ عبارتند از CNBr، فرمیک اسید و هیدروکسیل آمین. پروتئازهایی که معمولا جهت جداسازی پروتئین نوترکیب استفاده می شوند عبارتند از ترومبین، فاکتور Xa، انتروکیناز، پروتئاز ویروس تنباکو (TEV)و پروتئاز SUMO. به طور کلی کلیواژ با کمک آنزیم به علت اختصاصیت بالاتر و توانایی انجام در شرایط عادی نسبت به روش شیمیایی برتری دارد. غیر از پروتئاز SUMO باقی آنزیمهای ذکر شده دارای توالی کوتاه و شناخته شدهای هستند.
برای یک آنزیم پروتئاز خاص، ممکن است کیفیت کلیواژ در فیوژن پروتئینهای مختلف متفاوت باشد. ممانعت فضایی یا وجود رزیدوهای نامناسب در اطراف جایگاه برش ممکن است باعث پایین آمدن کیفیت کلیواژ بشود. در ضمن هنگام تولید پروتئین در مقیاس بالا،استفاده از این آنزیم ها اصلا مقرون به صرفه نبوده و بسیار هزینه بر میباشد. از این منظر استفاده از کلیواژ شیمیایی مناسب تر بوده اما مشکل کلیواژ شیمیایی در این است که کمتر از کلیواژ آنزیمی اختصاصیت دارد و معمولا به شرایطی خاصی نیاز دارد که گاهی خود باعث تغییر در زنجیرههای جانبی پروتئین میگردد. علاوه بر این امکان وجود بیش از یک جایگاه شناسایی بر روی پروتئین وجود دارد و این به نوبه خود کار را محدود مینماید. به طور کلی میتوان گفت، کلیواژ شیمیایی در مواردی که پروتئین هدف کوچک است و یا قابل کلیواژ با پروتئازها نیست مناسب میباشد. از نقاط ضعف هر دوی این روشها میتوان به این موضوع اشارهکرد که به دلیل استفاده از محلولهای شیمیایی خاص(در کلیواژ شیمیایی) و وجود پروتئازها که خود پروتئینی بوده و عامل ناخالصی هستند(در کلیواژ آنزیمی) معمولا نیاز است تا یک مرحله کروماتوگرافی اضافی انجام شود تا پروتئین هدف از باقی محلول کلیواژ نیز جداسازی گردد؛ در نتیجه در کارهای با مقیاس بالا این مرحله نیز هزینه بر بوده و مقرون به صرفه نخواهد بود.
به طور کلی در تحقیقات زیست فناوری دنبالههای پپتیدی را به چهار دسته اصلی تقسیم بندی میکنند:
- دنبالههای تمایلی
- دنبالههای محلولکننده
- دنبالههای خودبرش دهنده
- دنبالههای بدون نیاز به ستون کروماتوگرافی
دنبالههای تمایلی
اولین دنبالههای تمایلی استفاده شده پروتئینهای بزرگی بودند که منحصرا در باکتری Escherichia coli به منظور بیان و تخلیص پروتئین هدف استفاده میشدند. اما به هر حال این بالا بودن وزن پروتئینی باعث دناتوراسیون یا کاهش فعالیت پروتئین هدف می گشت.
استفاده از دنبالههای تمایلی برای تخلیص آسان پروتئینهای نوترکیب امروزه بسیار رایج است؛ اما به هر حال خود این دنبالهها در مراحل آخر تخلیص باید حذف شوند. این مرحله پروتئولیز اضافی خود باعث ایجاد تداخل در تخلیص میشود و حتی امکان این نیز وجود دارد که پروتئین تولید شده نیز توسط پروتئازها از میان بروند. این مشکل را میتوان از طریق تلفیق دنبالهی تمایلی به یک دنبالهی خود برش دهنده و سپس تلفیق با پروتئین هدف بر طرف نمود. به این صورت با افزودن دیتیوتریتول، مرکاپتواتانول و یا سیستئین (در دمای پایین) دنبالهی خود برش دهنده از محل خودبرش دهندگی برش خورده و از طرفی چون هنوز به دنبالهی تمایلی متصل است، طبیعتا دنباله نیز به ستون متصل بوده در نتیجه فقط پروتئین هدف ما درون فراکشنهای حاصل از تخلیص مشاهده خواهد شد. با این روش جدید ما دیگر نیازی به مرحله پروتئولیز نخواهیم داشت.
از جمله معروفترین دنبالههای این دسته میتوان به Poly His-tag، FIAG و CBD اشاره کرد.
دنبالهی تمایلی پلی هیستیدین
دنبالهی پلی هیستیدین یا به اختصار 6xHis-tag یکی از رایجترین دنبالههای مورد استفاده میباشد. این دنباله برای اولین بار در سال 1988 مورد استفاده قرار گرفت. این دنباله تاثیری روی افزایش بیان پروتئین هدف نداشته اما سبب افزایش حلالیت پروتئین هدف میگردد. معمولا برای تخلیص ابتدا با استفاده از سانتریفیوژ، روشهای فیزیکی، دترجنتها و آنزیمهایی مثل لیزوزیم سلولها عصاره گیری میشوند. سپس با استفاده از ستون نیکل یا کبالت کروماتوگرافی و جداسازی میشود.
دنبالهی تمایلی CBD
این دنباله از باکتری باسیلوس سیرکولانس گرفته شده و دارای 51 اسیدآمینه میباشد. در واقع توالی کدکنندهی دامنه اتصال به کیتین است و به بیدهای کیتینی موجود در ستون کروماتوگرافی متصل میشود. از مزیتهای آن میتوان به عدم نیاز به بافر یا تغییرات خاصی در شرایط مختلف برای اتصال به بیدهای کیتینی عنوان کرد.
دنبالهی CBD با کروماتوگرافی ستونی با رزین کیتینی قابل جداسازی است. کروماتوگرافی تمایلی کیتین برخلاف محلولهایی مثل اوره و گوانیدین هیدروکلراید، باعث دناتوره کردن پروتئین نمیشود. افزودن غلظت پایینی از دترجنتهای غیر یونی مانند Tween 20با توجه به خصوصیات طبیعی فیوژن پروتئین در مواردی توصیه میگردد. افزودن غلظتهای پایین از محلولهای احیا کننده ممکن است در حین تخلیص استفاده شود، اما افزودن غلظت بالایی از این مواد سبب تحریک خاصیت خود برشدهندگی در INT میشود.
دنبالههای محلولکننده
این دسته از دنبالهها باعث افزایش پایداری و حلالیت پروتئین میگردند. مثل گلوتاتیون اس ترانسفراز، پروتئین متصل شونده به مالتوز (MBP ) و SUMO.
دنبالههای خود برش دهنده
این دسته از دنبالهها توانایی برش دادن خود بدون نیاز به آنزیم یا مواد شیمیایی را دارند. میتوان از این نوع دنباله به سورتازآ، پروتئاز انتهای آمین و اینتئین ها اشاره کرد. در واقع یکی از مزیتهای این سیستم تولید پروتئین و جداسازی آن بدون کمک پروتئازها است.
دنبالههای بدون نیاز به ستون کروماتوگرافی
این دنبالهها دارای خاصیتهایی هستند که با استفاده از آن میتوان بدون نیاز به ستون کروماتوگرافی، عمل تخلیص را انجام داد. مانند پروتئین های شبه الاستینی یا ELPاست. یکی از ویژگی های منحصر به فرد ELPها داشتن دمای انتقال فاز است. دمای انتقال فاز دمایی است که در بالاتر از آن پروتئین فرم حلقوی پیدا کرده و رسوب میکند. از همین خاصیت می توان برای تخلیص پروتئین ها بدون نیاز به استفاده از کروماتوگرافی بهره برد.
در آخر برای بررسی پروتئین ها از تکنیک SDS-PAGE استفاده میشود که در بسیاری از زمینه های بیولوژی استفاده میشود. این تکنیک نیز در این سایت توضیح داده شده است.